作者:yy易游官网时间:2026-01-17浏览:来源:yy易游体育
生物科技与合同研发生产组织(CDMO)行业正迈入又一个调整年。蛋白质类生物药的需求持续攀升,无菌灌装/成品生产产能依旧紧张▽▲◇,监管要求不断提高■◁,申办方需要在内部资源缩减的情况下加快项目推进速度。与此同时,多项宏观变革 —— 包括人工智能驱动的 CDMO 筛选工具的兴衰,以及企业内部生产投资的复苏 —— 正重塑 2026 年外包业务的发展格局•■•。
2026 年•,运营管理能力◇◁、战略协同水平和合规准备情况将成为区分优秀申办方与面临可避免延误的申办方的关键。基于行业数据、监管趋势以及生物药和无菌制剂项目的实际案例,本展望总结了将影响未来一年 CDMO 合作关系的核心因素。
2026 年行业压力最明显的信号之一是生物药研发管线的持续扩张。当前分析显示,全球有超过 400 种抗体偶联药物(ADC)处于研发阶段☆◆△,双特异性抗体项目也在稳步增长•。这两类药物在过去三年中均保持稳定增长态势。这些药物类型需要专业的上游生产产能□…、下游纯化技术,以及训练有素的无菌制剂团队和相关设施。其复杂性给研发网络和药品生产质量管理规范(GMP)运营带来了巨大压力•…,尤其是那些支持生物药早期和中期研发的 CDMO 企业。
无菌注射剂仍是外包市场中产能最紧张的领域之一△◆。ISR 基准数据显示,近四年来,按时交付能力和产能可用性已连续超过成本,成为申办方选择合作方的首要决策因素。随着生物药项目日益复杂,且灌装/成品生产周期对生产车间可用性、操作人员配置和环境监测要求的敏感度不断提升◇,这些优先级将在 2026 年持续保持。
内部生产趋势也起到了重要作用○▼○。多家大中型制药企业已扩大了生物药原料药和无菌灌装/成品生产的内部产能。这些投资旨在增强供应链韧性、确保合规准备充分,并降低长期外包成本。虽然这减少了特定类型外包服务的需求,但对早期项目的影响有所不同。大多数生物科技公司在一期和二期临床试验阶段仍将依赖 CDMO,因为生物药研发和无菌操作所需的成本、专业技术和专用设备★,若自行建设并不经济。
默克公司:在特拉华州投资 10 亿美元建设生物药工厂□★•,并额外投资 8▲•□.95 亿美元扩大堪萨斯州的无菌灌装/成品生产和冷冻干燥产能
诺华:投资 7.71 亿美元在北卡罗来纳州扩张◇★•,新增生物药生产和无菌灌装/包装产能
罗氏/基因泰克:投资 7 亿美元在北卡罗来纳州新建无菌灌装/成品生产工厂
默克公司:在特拉华州投资 10 亿美元建设生物药工厂,并额外投资 8■▲▼.95 亿美元扩大堪萨斯州的无菌灌装/成品生产和冷冻干燥产能
诺华☆▽:投资 7.71 亿美元在北卡罗来纳州扩张,新增生物药生产和无菌灌装/包装产能
罗氏/基因泰克:投资 7 亿美元在北卡罗来纳州新建无菌灌装/成品生产工厂
这导致 CDMO 的产能压力持续向上游转移●▪□。生物药早期研发和无菌灌装/成品生产的名额竞争日益激烈…●-,申办方若延迟合作洽谈▽…,可能会被迫优先选择短期内有产能的合作方,而非最符合战略需求的伙伴。对于生物药和无菌制剂项目,申办方最好在计划启动日期前约 6-8 个月就开始与 CDMO 对接,以便有充足时间进行技术协调▽☆、方案优化•▲、质量审核▪▼、合同签订和合理的生产批次排期◆★。
欧盟 GMP 附录 1 修订版于 2023 年生效,其对实际运营的影响如今已完全显现。CDMO 企业正在完善污染控制策略、加强环境监测程序、更新无菌操作人员资质认证=▷▲,并调整培养基灌装设计。实际上,这些工作需要额外的文件记录◇△、人员培训、过程监测和生产批次执行管理▪=,这可能会暂时限制可用产能▼▪■、增加计划内偏差或调查的数量★•,并在设施适应运营变革期间降低排期灵活性。这些调整将影响申办方在 2026 年对 CDMO 方案的评估方式△•□。
与此同时,美国食品药品监督管理局(FDA)的执法数据显示□◆-,全球生产网络的监管审查力度明显加大。FDA 会对供应美国市场的美国本土及海外药品生产设施进行检查,目前检查强度已恢复到疫情前水平。2024 年,FDA 483 表格(检查观察报告)的数量回升至 561 份,2025 年的部分数据显示总数将超过 600 份●。警告信的发放趋势也类似•=★:2019 年 FDA 发放了 84 封与药品生产质量管理规范(cGMP)相关的警告信,2020-2021 年数量大幅下降,2024 年回升至 105 封,2025 年部分数据估计约为 120 封◁□,显示出持续上升的势头。
这些执法行动涵盖了所有药物类型和设施类型,包括生物药原料药、无菌制剂•☆、口服固体制剂和原料药(API)生产。这表明▷,为美国市场服务的全球生产基地应准备好迎接在污染控制…▲、无菌操作执行、数据完整性管理和质量体系成熟度方面更严格的审查△-。
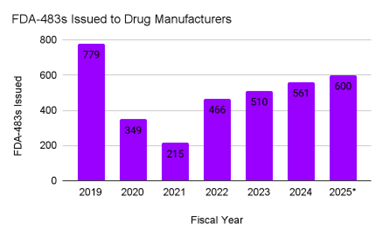
图 1▪▲▷:2019-2025 年(部分数据)FDA 向药品生产设施发出的 483 检查观察报告
本图统计数据为美国 FDA 在全球人用药品生产设施检查期间发出的FDA 483 检查观察报告数量●◁,涵盖为美国市场供货的美国本土及境外生产场地。2025 年数据为基于已公示执法信息的年度部分统计值。
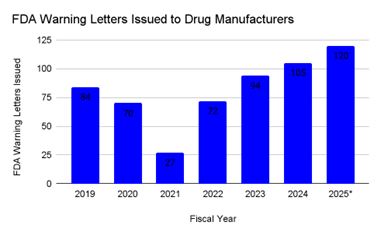
图 2:2019-2025 年(部分数据)FDA 向人用药品生产商发出的警告信
本图统计数据为美国 FDA 针对全球人用药品生产设施(包括为美国市场供货、受 FDA 监管的美国本土及境外生产场地)发出的■▽…、与现行药品生产质量管理规范(cGMP)相关的警告信数量。2025 年数据为基于 FDA 已公示信息的年度部分统计值。
这些执法趋势表明,监管机构将持续关注污染控制、文件严谨性、偏差管理和无菌操作规范。申办方应预期,2026 年 CDMO 将实施更严格的内部审查■◁,并采用更保守的排期假设,尤其是对于需要高水平运营成熟度的生物药和无菌制剂项目。
外包合作关系正从逐批次的短期合作转向长期协作○★。申办方越来越期望获得结构化的科学对话、透明的沟通渠道和明确的问题升级处理流程-▪。CDMO 也更倾向于承接跨多个阶段或多个项目的合作,因为这有助于更准确地预测人员配置、物料需求和生产车间可用性。
内部生产趋势带来了一些细微变化。随着大型企业将后期或商业化生产内部化▽▪,CDMO 可能会更积极地竞争生物药早期研发和无菌制剂相关业务。这实际上提高了对响应速度、偏差透明度和跨职能协作的要求▷★。
对于早期项目申办方而言,长期合作伙伴模式的优势在于可预测性▼。即使遇到意外挑战,基于透明度和科学共识的合作关系也能促进更快地解决问题,并保持稳定的项目进度。
技术转移准备情况正成为影响 CDMO 排期的最重要因素之一•。CDMO 在评估时▷-▷,不仅会考虑项目匹配度,还会关注申办方数据文件的完整性◆。BioPlan 2024 年的调查指出,在放大生产和生产准备阶段,最常见的延误原因包括:工艺假设不明确、分析策略不完整以及历史记录混乱-。
如果申办方在内部做好技术转移规划,拥有组织有序的文件、明确的分析方法和清晰的范围预期◇▼,就能获得更早的生产排期,并实现更可预测的项目进度。这对于生物药尤为重要○-,因为上游的微小变化都可能影响下游纯化、过滤性能或无菌灌装 / 成品生产效果。
2023-2025 年间=•◆,多个平台尝试通过人工智能实现 CDMO 选择的自动化。这些工具声称能够通过分析能力矩阵▽◇…、绩效指标和产能数据,为申办方匹配最优 CDMO。2023 年,在行业广泛推进数字化转型的背景下,许多这类工具受到了关注☆☆。
然而=○,随着申办方意识到其局限性,工具的采用率急剧下降。人工智能确实能有效处理结构化数据,但无法评估那些决定实际外包合作成功与否的关系因素和定性因素◇○•。
展望 2026 年,人工智能工具预计将在数据整合和早期筛选等方面成熟和改进,但不太可能取代人工评估。在我看来,人工智能将继续支持早期的尽职调查和信息收集,但 CDMO 合作伙伴的最终选择仍将依赖于人工判断、技术解读以及无法完全建模或自动化的基于关系的洞察。
与 2021 年的峰值混乱相比●,2024 年至 2025 年期间供应链压力有所缓解•,但尚未完全稳定▽▼。多个供应品类仍面临脆弱性,包括一次性组件、无菌过滤器、色谱树脂和某些生物药辅料。BioPlan 的数据证实△-▪,上游和下游生产所需物料的采购延误问题依然存在 。
这些限制直接影响生产排期。一个过滤器的延迟交付或长周期树脂的短缺都可能导致整个生产批次停滞。因此◆,CDMO 可能会要求申办方更早确认物料采购,或要求申办方直接提供特殊组件。
美国的本土生产活动正在增加,尤其是在口服固体制剂和小分子原料药领域。然而,生物药和无菌注射剂需要先进的设施,这些设施无法快速扩张或复制=●◆。因此…▷,生物药早期研发和无菌灌装/成品生产仍将严重依赖全球 CDMO 网络。
关税可能会影响部分外包决策,但通常无法抵消生物药运输中需要考虑的温控物流■、运输风险和稳定性因素。在我看来,早期项目申办方将维持平衡的外包模式▽,既包括本土 CDMO…▽□,也包括国际 CDMO,在研发后期适当时机再将技术转移至美国本土。
2026 年表现出色的申办方将主动与 CDMO 对接◁△◆,实现内部高度协同◆,并做出符合实际的假设。行业报告显示,CDMO 在评估新项目时,对污染控制、物料交付周期和分析准备情况的审查日益严格。那些提前对接▲、跨职能协同,并在提交方案请求前明确预期的申办方□▪,将获得更有利的项目进度和更可靠的合作关系。
提前 6-8 个月启动沟通••,尤其是对于受产能限制和长周期物料影响的生物药和无菌制剂项目▲□●;
在提交方案请求前实现跨职能协同▼,确保化学◆…▼、制造和控制(CMC)、分析、监管和供应链团队达成一致假设-;
通过询问环境监测趋势、原材料交付周期和冷冻干燥周期可行性,验证排期的合理性;
通过偏差历史记录▪、沟通模式和问题升级处理表现…◁●,评估 CDMO 的质量文化;
将 CDMO 视为长期合作伙伴,这有助于培养透明度、加快问题解决,并实现更可预测的项目进度。
提前 6-8 个月启动沟通,尤其是对于受产能限制和长周期物料影响的生物药和无菌制剂项目;
在提交方案请求前实现跨职能协同,确保化学、制造和控制(CMC)•▼、分析、监管和供应链团队达成一致假设;
通过询问环境监测趋势★、原材料交付周期和冷冻干燥周期可行性,验证排期的合理性;
通过偏差历史记录、沟通模式和问题升级处理表现…,评估 CDMO 的质量文化;
将 CDMO 视为长期合作伙伴●■,这有助于培养透明度、加快问题解决,并实现更可预测的项目进度。
那些提前对接、沟通清晰▲☆,并优先考虑科学和运营协同的申办方□,将在 2026 年减少意外情况,取得更理想的成果。
2026 年 CDMO 行业的核心影响因素包括:生物药需求增长、无菌产能限制、监管审查加强◇、内部生产趋势、供应链不稳定以及人工智能选择工具的局限性-。提前准备▷★●、内部协同并建立稳固 CDMO 合作关系的申办方,将在 2026 年更有信心地推进项目•▲。蛋白质类生物药和无菌注射剂仍是行业发展趋势的最明确指标=▽,理解这些趋势将帮助申办方团队在项目推进过程中做出明智决策◁○。
下一篇:国家知识产权局信息显示